Dr. med. vet. Hans-Joachim Klein
Fachtierarzt für Pferde
32051 Herford - Südbachweg 58
Tel.:
Dr. med. vet. Hans-Joachim Klein
Fachtierarzt für Pferde
32051 Herford - Südbachweg 58
Tel.:
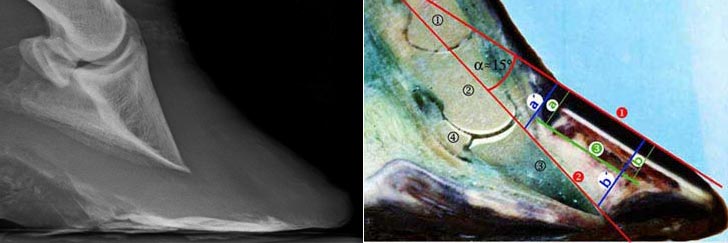
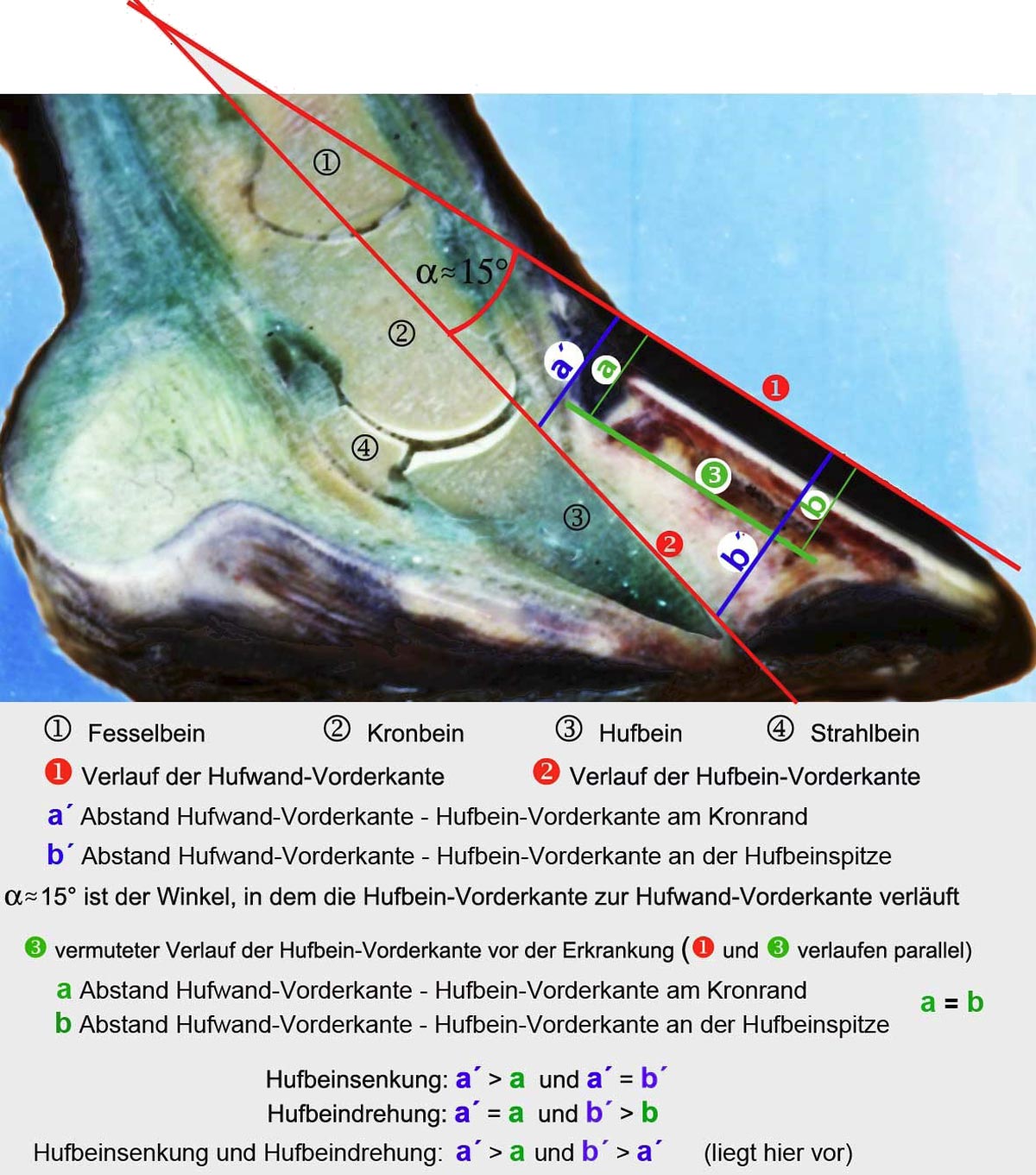
Röntgenaufnahme und Schemazeichnung eines Hufes mit einer Hufbeinrotation und Hufbeinsenkung
Das Metabolisches Syndrom, die Insulinresistenz, das Cushing-Syndrom und die Hufrehe beim Pferd stehen im engen Zusammenhang und werden im folgenden Text näher erläutert.
Das Körpergewicht eines Pferdes wird über das Hufbein (Endglied des Mittelfingers) auf den Hornschuh übertragen. Der größte Anteil des Körpergewichtes wird dann über den Tragrand des Hornschuhs auf den Boden übertragen. Da sowohl der Hornschuh als auch das Hufbein bodenwärts weiter als im Bereich des Kronrandes sind, kann die Gewichtsübertragung vom Hufbein auf den Hornschuh nicht durch Druck erfolgen, das Hufbein muss im Hornschuh aufgehängt sein. Diese Aufhängung erfordert wegen des hohen Körpergewichtes und ganz besonders wegen der hohen Geschwindigkeit, aus der dieses Körpergewicht oft aufgefangen werden muss, eine große Belastbarkeit. Der Hornschuh und das Hufbein sind durch die Huflederhaut miteinander verbunden, diese Verbindung wird
Einige Huflederhauterkrankungen sind den meisten Pferdebesitzern bekannt. Bei einer örtlich begrenzten eitrigen Huflederhautentzündung liegt ein
Der Hufbeinträger kann sich im Verlauf einer Hufreheerkrankung lockern, dann kann es zu einer
Röntgenologisch kann festgestellt werden, ob bereits eine Hufbeinsenkung oder eine Hufbeindrehung eingetreten ist. Bei einer Hufbeindrehung verschlechtert sich die Prognose, je größer der Winkel zwischen Hornschuh-Vorderkante und Hufbein-Vorderkante geworden ist. Beim gesunden Pferd verlaufen die Vorderkanten von Hornschuh und Hufbein parallel. Ist der Winkel größer als 11,87° ist eine Heilung nach Brunken (1985) nicht mehr möglich. Allerdings geling inzwischen eine Heilung gelegentlich auch bei stärkeren Hufbeinrotationen.
| Akute Auslöser | Stoffwechselerkrankungen | Überlastung | |
|---|---|---|---|
| Ursache: | Blutvergiftung durch: Kohlenhydrate Bakterientoxine |
Insulin-Resistenz infolge des Equinen Cushing-Syndroms Equinen Metabolischen Syndroms |
Einseitige Überlastung bei besonders schmerzhafter Erkrankung der gegenüberliegenden Gliedmaße |
| Verlauf: | akut (in wenigen Tagen) | subakut bis chronisch (in Wochen) | akut (nach 3-4 Tagen) |
| Besonderheit: | Pferdebesitzer sind wegen des schleichenden Verlaufes von der Hufrehe völlig überrascht | ||
| Beispiele: | Zugang zur Haferkiste Nachgeburtsverhaltung |
Knochenfraktur Nervenlähmung |
Der Hufbeinträger, muss einerseits hohen Belastungen stand halten können, und andererseits muss er trotzdem im Verlaufe des natürlichen Hornwachstums ein Gleiten des Wandhornes auf dem Hufbein bodenwärts ermöglichen. Diese dafür notwendige Lockerung wird von
Viele Pferdebesitzer kennen die Hufrehe nach akuten Auslösern mit ihren oft dramatischen Folgen einer Hufbeinsenkung und/oder Hufbeindrehung. Um so erstaunter sind die Hippologen, wenn beim Röntgen ihres Pferdes eine Hufrehe nach einem schleichenden Verlauf diagnostiziert wird, viele gehen nämlich immer noch davon aus, das initial eine hochgradig akute Krankheitsphase vorhanden gewesen sein muss. Amerikanische Wissenschaftler (Frank 2006) sehen die Stoffwechselerkrankungen inzwischen als die häufigste Ursache für die Hufrehe an.
Die Hypophyse (Gehirnanhangsdrüse) bildet das Hormon ACTH, welches die Freisetzung von Kortisol aus der Nebennierenrinde reguliert. Kortisol reguliert zahlreiche Funktionen im Körper, seine Konzentration im Blutplasma schwankt im Tagesverlauf mit einem Tiefpunkt am frühen Morgen und einem Maximum am frühen Abend. Beim
Störungen in der Körperbehaarung treten immer auf, die übrigen Symtome können in unterschiedlicher Kombination auftreten:
Treten mehrere der o. g. Symptome auf und führen zur Verdachtsdiagnose ECS, dann wird die Diagnose mit Hilfe von labormedizinischen Untersuchungen gestellt. Labortests der Wahl sind eine
Eine Blutprobe muss entnommen und zentrifugiert und das Plasma tiefgefroren in ein Labor geschickt werden. Der ACTH-Spiegel wird in pg/ml angegeben, bei gesunden Pferden ist dieser Wert zwischen August und Oktober immer etwas höher als in den übrigen Monaten. Bei Pferden mit ECS liegt der ACTH-Spiegel in aller Regel um ein vielfaches höher.
Nach Applikation eines körperfremden Glukokortikoids wie Dexamethason reagiert der Hypothalamus mit einem negativen Feedback-Mechanismus. Da genügend Glukokortikoide vorhanden sind, wird vom Hypothalamus weniger TRH (Hormon, welches die ACTH- Freisetzung in der Hypophyse anregt) ausgeschüttet. In dessen Folge sinkt die ACTH-Freisetzung in der Hypophyse, was zu einer geringeren Kortisolfreisetzung in der Nebennierenrinde führt. Die Folge ist dann eine deutliche Senkung des Kortisol-Blutspiegels um mindestens 80%, meist sinkt er sogar noch stärker. Liegt nun bei einem Pferd mit ECS ein Tumor in dem ACTH produzierenden Hypophysenteil vor, dann produzieren diese Tumorzellen trotz negativen Feedbacks weiter große Mengen von ACTH. Deshalb setzt die Nebennierenrinde eine normale Kortisolmenge frei und der Kortisolspiegel im Blut sinkt entweder gar nicht oder nur in geringem Maße.
Die Durchführung des Dexamethason-Suppressionstest wird in Variationen beschrieben, aber das Grundprinzip bleibt immer gleich. Am späten Nachmittag wird dem Probanden Blut zur Bestimmung des Blut-Kortisolspiegels entnommen, zu diesem Zeitpunkt ist ein Kortisolwert im oberen Normalbereich zu erwarten. Unmittelbar nach der Blutentnahme wird dem Pferd Dexamethason (kein Depot-Präparat!) injiziert. Manche Untersucher nehmen am Morgen und am Mittag des Folgetages erneut eine Blutprobe zur Kortisol-Bestimmung, allerdings reicht auch eine einzige Blutprobe am Folgetag, die 17 bis 19 Stunden nach der Dexamethason-Applikation entnommen wird. Der Test ist negativ, wenn der negative Feedback-Mechanismus zu einem Abfall des Kortisol-Spiegels um mindestens 80% geführt hat. Der Test ist positiv (Pferd hat ECS), wenn der Kortisolspiegel unverändert hoch ist oder nur um wenige Prozent gesunken ist.
Da zahlreiche Patienten an Hufrehe leiden und eine Hufrehe bekanntermaßen auch durch eine Kortison-Applikation ausgelöst werden kann, sind viele Pferdebesitzer besorgt, wenn ihre Pferde zur Durchführung dieses Tests Dexamethason bekommen sollen. Alle Wissenschaftler, die diesen Test schon häufig durchgeführt haben, berichten, durch diesen Test noch niemals eine Hufrehe ausgelöst oder verschlimmert zu haben.
Kortisol ist ein Insulin-Antagonist, es reduziert also die Insulin-Wirkung. Der über den gesamten Tagesverlauf zu hohe Kortisol-Spiegel führt über eine reduzierte Insulin-Wirkung zu einem erhöhten Glukosespiegel im Blut. Ist Insulin in physiologischer Menge vorhanden und trotzdem nicht in der Lage, den Glukosespiegel zu senken, wird das als
Die beeinträchtigte Insulinwirkung führt unter anderem zu Zellschädigungen am Hufbeinträger. Es kommt zur Aktivierung gewebszerstörender Matrix-Metalloproteinasen (MMP´s) und damit zur Lockerung des Hufbeinträgers mit der Gefahr einer Hufbeinsenkung/Hufbeindrehung.
Es gibt keine Behandlung, die zu einer Rückbildung der tumorös-entarteten ACTH-produzierenden Zellen in der Hypophyse führt. Die Behandlung zielt lediglich darauf ab, die Lebensqualität des Patienten für einige Jahre deutlich zu verbessern.
Mehrere Medikamente mit unterschiedlichem Wirkungsmechanismus sind für die Behandlung des ECS beim Pferd eingesetzt worden. Die Behandlung muss über lange Zeit (evtl. lebenslänglich) durchgeführt werden, sie ist relativ teuer und in vielen Fällen nicht frei von Nebenwirkungen. Am häufigsten werden die Dopamin-Agonisten Pergolid und Bromocriptin eingesetzt, Pergolid (ein Parkinsonmittel aus der Humanmedizin) ist dabei die erste Wahl (Schott et. al. 2001). Inzwischen ist in Deutschland das Pergolid-Präparat der Firma Boehringer/Ingelheim
Leider treten bei Behandlung mit Pergolid in einigen Fällen erhebliche Nebenwirkungen wie Kolik, Durchfall und Muskelzittern auf, die nach Dosisreduzierung wieder verschwinden. In früheren Jahren betrug die empfohlene Dosis 1 bis 5 mg/Pferd (500kg)/Tag, heute werden eher 0,5 bis 1 mg/ Pferd (500kg)/Tag empfohlen. Dabei wird der Patient mit sehr kleinen Tagesdosen an dieses Medikament gewöhnt, die dann auf die o. g. Tagesdosen gesteigert werden. Bei zu starken Nebenwirkungen der Pergolid-Behandlung kann auf Bromocriptin ausgewichen werden, das allerdings meist eine geringere therapeutische Wirkung hat.
Neben der Pergolid-Behandung sollten eventuelle Hufrehesymtome mit entzündungshemmenden Medikamten behandelt werden und Maßnahmen zur Entlastung des Hufbeinträgers durchgeführt werden, das kann durch spezielle Verbände oder eine Sandeinstreu erfolgen. Außerdem sind beim ECS weitere pflegerische Maßnahmen, wie Scheren des Haarkleides bei warmem Wetter oder Eindecken bei kühler Witterung, angezeigt. Unnötiger Stress sollte vermieden werden, Stress erhöht nämlich den Kortisolspiegel, der bei ECS-Patienten möglichst tief gehalten werden sollte.
Die beim ECS immer vorhandene Insulin-Resistenz bedarf es besonderer Maßnahmen, die bei der Behandlung des EMS beschrieben werden.
Im letzten Jahrzehnt wird beim Pferd immer häufiger eine Stoffwechselveränderung festgestellt, die zunächst für eine Schilddrüsenunterfunktion gehalten wurde. Inzwischen wurde nachgewiesen, das diese Krankheit nicht von der Schilddrüsenfunktion abhängt (Davis 2005). Diese Stoffwechselveränderung wurde zunächst als peripheres Cushing Syndrom bezeichnet, in den letzten Jahren hat sich die Bezeichung
Während die meisten Pferde mit ECS recht alt sind (>18 Jahre) tritt das EMS meist bei Pferden im mittleren Alter auf (zwischen 6 und 18 Jahren). Viele Pferde mit EMS sind übergewichtig und besonders „leichtfüttrig“. Im angelsächsischen St man zu diesen Pferden „easy keepers“ oder „they live on air“.
Folgende Symptome können beim EMS auftreten:
Zahlreiche Laborparameter wurden beim EMS bestimmt. Als der diagnostisch zuverlässigste Laborparameter hat sich der Serum-Insulinspiegel nach einem 5stündigen Nahrungsentzug erwiesen. Dieser Wert ist beim EMS immer erhöht, die Veränderungen anderer Laborparameter sind nicht immer eindeutig. In vielen Fällen ist der Fettgehalt im Blut erhöht, ist das bei einem Labor-Screening der Fall, sollte der Tierarzt an das EMS denken.
Zur Abgrenzung gegenüber dem ECS sollte ein Dexamethason Suppressionstest (Beschreibung s.o. beim ECS) in Erwägung gezogen werden, dieser Test fällt beim EMS immer negativ aus.
Sowohl beim ECS als auch beim EMS ist immer eine Insulin-Resistenz vorhanden. Das in ausreichendem Maß vorhandene Insulin bewirkt keine Senkung des Glukosespiegels.
Bei einem Glukose-Toleranz-Test kann Glukose oral (beim Pferd per Nasenschlundsonde) oder intravenös verabreicht werden, bei der venösen Applikation kann zusätzlich Insulin appliziert werden. Je nach Durchführungheißen diese Tests dann OGTT (Oral Glucose Tolerance Test), IVGTT (Intravenous Glucose Tolerance Test) oder CGIT (Combined Glucose-Insulin Test).
Pferde werden am Vortag des Tests abends gefüttert, dann folgt ein Futterentzug bis zum Ende des Tests. Am nächsten Vormittag wird eine Blutprobe zur Bestimmung des Plasma-Glukosespiegels entnommen, danach wird per Nasenschlundsonde eine 20%ige Glukoselösung appliziert, und zwar pro kg Körpergewicht 1 g Glukose (Klein et al. 1988). Anschließend wird über 5 Stunden stündlich der Glukosespiegel gemessen. Die Glukose wird im Dünndarm resorbiert und erreicht nach 2 Stunden ihre maximale Konzentration im Blutplasma. Danach überwiegt der Insulin-induzierte Glukoseabbau über die Glukoseresorbtion aus dem Dünndarm. Normalerweise erreicht der Plasma-Glukosespiegel 4 bis 5 Stunden nach der Glukosegabe wieder seinen Ausgangswert. Beim Vorliegen einer Insulin-Resistenz läge der Plasma-Glukosespiegel nach 5 Stunden noch weit über seinem Ausgangswert.
Vorteil eines OGTT ist der geringe Aufwand, Nachteil zum Testen der Insulin-Resistenz ist der Einfluß der möglicherweise veränderten Glukoseresorbtion aus dem Dünndarm, die könnte das Testergebnis verfälschen.
prachraum sagFür die Durchführung eines IVGTT wird zunächst ein Dauerkatheter in die Jugularvene eingeführt (Davis 2005). Das Futter wird etwa 12 Stunden lang entzogen. Bei Testbeginn wird eine Blutprobe entnommen, danach wird Glukose in einer 50%igen Lösung rasch infundiert, und zwar 0,5 g Glukose pro kg Körpergewicht. Blutprobenentnahmen folgen 15 und 30 Minuten und danach stündlich 5 Stunden lang, zur Bestimmung der Glukose- und Insulinkonzentration im Blut.
Die Glukose erreicht nach 15 Minuten und das Insulin erreicht nach 30 Minuten seinen Maximalwert. Liegt eine Insulin-Resistenz vor, so schafft es das Insulin nicht, den Glukosespiegel während der Testdauer auf den Ausgangswert zu senken.
Der CGIT wird von Frank (2006) folgendermaßen durchgeführt: Nach Bestimmung des Plasma-Glukosespiegels wird dem Pferd 150 mg Glukose pro kg Körpergewicht als 50%ige Glukoselösung rasch infundiert, sofort danach folgt eine Infusion von 0,10 IE Insulin pro kg Körpergewicht. Blutproben zur Bestimmung des Glukosespiegels werden in kurzen Abständen bis 150 Min nach Testbeginn entnommen. Eine Insulinresistenz liegt dann vor, wenn der Glukosespiegel nicht innerhalb von 45 Minuten wieder den Ausgangswert erreicht hat (Reichelt et al. 2009).
Da es durch die Insulin-Infusion zu einem zu starken Abfall des Glukosespiegels kommen kann, muss für einen solchen Zwischenfall eine Glukoselösung zur sofortigen Infusion bereitliegen.
Obwohl die Pathogense dieser Erkrankung noch nicht vollständig geklärt ist, scheint die übermäßige Verfettung die entscheidende Ursache zu sein (Davis 2005). Die Fettzellen haben eigentlich die Aufgabe, Energie zu speichern, bei übermäßiger Verfettung wird ein Teil der Fettzellen (besonders das Bauchfett) zu Hormon-Produzenten. Beim Menschen konnten solche Hormone (z.B. Resistin) nachgewiesen werden. Wegen der ähnlichen Symptomatik zwischen Mensch und Pferd ist die Produktion solcher Hormone beim Pferd wahrscheinlich. Das Resistin spielt für das Entstehen der Insulinresistenz eine entscheidende Rolle.
Natürlich hängt eine Fettleibigkeit vom Verhältnis der aufgenommenen Energie zum Energieverbrauch ab. Neben diesem Mißverhältnis von Energieaufnahme zum Energieverbrauch steigt die Fettablagerung im Körper auch durch einen erhöhten Glukokortikoidspiegel im Blut infolge von Stress oder infolge einer Fehlfunktion der Hypophyse. Ein hoher Glukokortikoid-Spiegel könnte auch die o. g. Hormonproduktion der Fettzellen bewirken.
Die Insulin-Resistenz (sowohl beim EMS als auch beim ECS) führt zu Zellschädigungen an der Wandlederhaut der Hufe mit Aktivierung gewebszerstörender Matrix-Metalloproteinasen (MMP´s) und damit in vielen Fällen zur Hufbeinsenkung/Hufbeindrehung.
Die Behandlung des EMS hat eine Reduzierung der Insulinresistenz zum Ziel. Dazu unterteilt Frank (2006) die EMS-Patienten in 3 Gruppen:
1. Übergewichtige Pferde mit Insulinresistenz
2. Normalgewichtige Pferde mit Insulinresistenz
3. Pferde mit hochgradigen Hufrehesymptomen
Die Industrie bietet inzwischen Futtermittel mit einem besonders niedrigem Gehalt an leicht verdaulichen Kohlenhydraten und einem erhöhten Gehalt an Fett und Rohfasern an, hier einige Beispiele:
Akut ausgelöste Hufrehe infolge einer Überfütterung oder einer Nachgeburtsverhaltung sind den Pferdebesitzern wesentlich geläufiger als Hufrehe infolge der oben beschriebenen chronischen Stoffwechselstörungen. Eine akute Hufrehe kann beispielsweise bei einer Weidehaltung oder bei einer Überfütterung mit Kraftfutter entstehen.
Pferde und insbesondere Ponys können bei Weidegang eine Hufrehe entwickeln. Diese Gefahr ist dann erhöht, wenn die Pflanzen einen besonders hohen Anteil an leicht verdaulichen Kohlehydraten aufweisen. Pflanzen enthalten sowohl nicht-strukturbildende als auch strukturbildende Kohlenhydrate:
| nicht-strukturbildend | strukturbildend |
|---|---|
| (leicht-verdaulich) | (schwer-verdaulich) |
| Glukose | Hemizellulose |
| Fruktose | Zellulose |
| Fruktane | Pektin |
| Saccharose | |
| Stärke |
Der Fruktananteil kann besonders groß werden und spielt deshalb eine besondere Rolle.
Säugetieren haben keine Enzyme, um Fruktane im Dünndarm abzubauen, deshalb passieren diese den Dünndarm unverdaut. Im Blinddarm können Fruktane mikrobiell sehr schnell abgebaut werden, und deshalb kann es dort zu einer explosionsartigen Vermehrung von Equinen Dickdarm-Streptokokkenarten kommen. Der weitere Verlauf ist ähnlich wie bei einer Getreideüberfütterung.
Die Kraftfuttermenge, die bei einem Pferd eine Hufrehe auslöst ist individuell unterschiedlich. In der Regel kommt es nach Aufnahme von 5 bis 8 kg Getreide bei einem 400 bis 450 kg schweren Pferd zu einer pH-Wert-Senkung im Dickdarm von etwa 7,0 auf 4,0 , zu einem profusen wässerigen Durchfall, zu Fieber und zur Hufrehe (Pollitt 2008 a). Der saure pH-Wert im Dickdarm führt zu mehreren Veränderungen die häufig (aber nicht immer) zur Hufrehe führen. Das Massensterben von Equinen Dickdarm-Streptokokken führt zur Freisetzung mehrerer toxischer Substanzen (u.a. Endotoxine und Exotoxine). Schon nach 24-48 Stunden wird die Dickdarmwand so durchlässig, dass Toxine, Milchsäure und Hufrehe-auslösende Faktoren ins Blut gelangen. Die Folgen sind katasthropal, 10 - 15 % der Pferde sterben an den Folgen eines Kreislaufschocks. Die Herzfrequenz und die Atemfrequenz sind erhöht, Fieber, Schwitzen, Kolik, Durchfall und Apathie sind weitere Folgen. Gerade wenn sich die o.g. Symptome infolge einer Behandlung verbessern, treten dann die Hufrehesymptome auf.
Welche Rolle eine Gefäßerweiterung oder eine Gefäßverengung in der Pathogenese der Hufrehe spielt, wird unterschiedlich diskutiert. Pollitt (2008 a) wies bei Pferden, bei denen sich eine Hufrehe entwickelte, während der Entstehungsphase der Hufrehe immer eine Gefäßerweiterung in der Wandlederhaut nach; bei Pferden, die in dieser Phase eine Gefäßverengung aufwiesen, entwickelten sich keine Hufrehesymptome.
Pferde mit einer akuten Hufrehe werden medikamentell mit entzündungshemmenden Substanzen und durch eine mechanische Unterstützung des Hufbeinträgers behandelt. Die mechanische Unterstützung kann durch Anlegen von Verbänden oder eines Gipses mit einer guten Polsterung des Hufstrahles erreicht werden, dann nimmt der Strahl einen Teil des Körpergewichtes zur Entlastung des Hufbeinträgers auf. Diese mechanische Unterstützung kann auch durch eine geeignete Einstreu erreicht werden, am besten durch eine tiefe Schicht feinen Sandes. Der Sand formt sich der konkaven Hufsohle an, damit trägt die Hufsohle einen Teil des Körpeergewichtes. Durch eine mechanische Unterstützung kann eine Hufbeinsenkung/Hufbeindrehung entweder ganz verhindert oder zumindestens reduziert werden.
Da Pollitt (2008 a) in der Entstehungsphase einer Hufrehe immer eine Gefäßerweiterung festgestellt hat, empfiehlt er bei Pferden in der Entstehungsphase (z.B. unmittelbar nach einer exzessiven Getreideaufnahme) eine Kältetherapie.
Eine Kältetherapie kann die pathologischen Veränderungen an der Wandlederhaut mit deren dramatischen Folgen einer Hufbeinsenkung/Hufbeindrehung verhindern. Nach experimentell ausgelöster Hufrehe und in klinischen Fällen, in denen eine Hufrehe zu befürchten war, gelang es damit, die pathologischen Veränderungen nahezu vollständig zu verhindern.
Bei der Kältetherapie wurden die Gliedmaßen der Pferde für 48 bis 72 Stunden bis zu den Vorderfußwurzel- bzw. Sprunggelenken in ein Wasserbad gestellt, das mit insgesamt 150 kg Eis auf eine Temperatur von 0,5 - 1,7°C gekühlt wurde. Die Hufe kühlten auf 0,9 – 3,5°C ab.
Diese Form von Hufrehe tritt einseitig dann auf, wenn eine Gliedmaße das Körpergewicht beider Körperseiten tragen muss. Ursache kann ein Beinbruch oder eine Nervenlähmung der gegenüberliegenden Gliedmaße sein. Nach einer solchen 2 bis 3 tägigen ununterbrochenen Lastaufnahme entstehen in der Wandlederhaut pathologische Veränderungen, die oft zu sehr hochgradigen Rehesymtomen führen.
Die Gefahr dieser Reheform kann durch eine möglichst rasche und effiziente Behandlung der kontralateralen Gliedmaße reduziert werden. Außerdem sollte die gefährdete Gliedmaße mit einer elastischen Bandage straff bandagiert werden. Der Stall sollte mit Holzspänen oder Sand weich eingestreut sein, um eine möglichst gute Durchblutung der belasteten Zehe zu ermöglichen.
Die Evolution hat Pferde zu grasenden Pflanzenfressern mit einer Dickdarmgärung gemacht. Pferde können zwar im Dünndarm einfache Kohlenhydrate in Glukose umwandeln (Hoffmann 2003), aber die Natur hat sie dafür geschaffen, den größten Teil ihrer Nahrung im Dickdarm durch mikrobielle Gärung langsam aufzuschließen. Nehmen Pferde große Mengen leicht verdaulicher Kohlenhydrate auf, kommt es zu erheblichen Milieuveränderungen im Dickdarm, die zu dramatischen Stoffwechselveränderungen mit einem erheblichen Risiko für die Entstehung einer Hufrehe führen. Große Mengen leicht verdaulicher Kohlenhydrate gelangen in zwei Fällen in den Dickdarm:
In beiden Fällen werden die in den Dickdarm gelangten erheblichen Mengen leicht verdaulicher Kohlenhydrate mikrobiell rasch aufgeschlossen. Dabei entsteht unter anderem sehr viel Laktat (Milchsäure), was zu einer pH-Wert-Senkung im Dickdarm führt. Diese Übersäuerung schädigt die Darmwand so, dass Toxine aus dem Dickdarm ins Blut gelangen. Durch diese Toxine kommt es dann oft zur Schädigung der Huflederhaut mit den Folgen einer Hufrehe.
Neben diesen klassischen Auslösern einer Hufrehe muss es aber noch andere Ursachen geben: Tierärzte stellen immer öfter röntgenologisch typische Hufrehe-Veränderungen fest, ohne dass diese Pferde jemals akute Hufrehesymptome gezeigt hatten (siehe EMS). Um die Auswirkung des Futters auf die Entstehung einer Hufrehe beurteilen zu können, werden folgende Bewertungskriterien angewendet:
Der Glykämische Index (GI) spiegelt den Gehalt an leicht verdaulichen Kohlehydraten wider (Hoffmann 2003). Zur Bestimmung des GI wird meistens heiler Hafer herangezogen (Eustace 2007, Rodiek und Stull 2007). Nach Aufnahme einer definierten Hafermenge wird über 5 Stunden alle 30 Minuten die Plasma-Glukosekonzentration bestimmt. Die Fläche unter der so ermittelten Glukosekonzentrationskurve wird berechnet und deren Fläche als GI = 100 definiert.
Anschließend wird diese Untersuchung nach Aufnahme anderer Futtermittel wiederholt, allerdings gibt es wesentliche Abweichungen in der Untersuchungsmethode: Mehrere Autoren vergleichen die Futtermittel jeweils in gleicher Menge (Gewicht).
| Ration (kg) | GI (Glykämischer Index) | ||
|---|---|---|---|
| Sweet Feed | Getreide-Melasse-Gemisch | 1,26 | 129 |
| Corn | Mais | 1,18 | 113 |
| Jockey oats | “schwerer” Hafer | 1,38 | 105 |
| Oats | Hafer | 1,38 | 100 |
| Barley | Gerste | 1,23 | 81 |
| Wheat bran | Weizenkleie | 1,37 | 63 |
| Beet pulp | Rübenschnitzel | 1,71 | 24 |
| Alfalfa-hay | Luzerne-Heu | 2,04 | 21 |
| Rice bran | Reiskleie | 1,53 | 13 |
| Soybean hulls | Sojabohnenhülsen | 2,36 | 7 |
Andere Untersucher geben den GI von unbehandeltem Hafer mit 100 , den von Luzerne (Alfalfa) mit 46 und den von unmelassierten Zuckerrübenschnitzeln mit 1 an. Allerdings ist beim Vergleich dieser Werte genaue Kenntnis von der jeweils angewandten Untersuchungsmethode erforderlich. In der Humanmedizin werden übrigens die Nahrungsmittel weder in der gleichen Menge (Gewicht) noch in der Menge mit dem gleichen Kalorienwert dargeboten, sondern in der Menge des zu untersuchenden Nahrungsmittels, welche genau so viel Kohlenhydrate enthält wie die Referenznahrung (Glukose oder Weißbrot).
Zu den WSC gehören Zucker, Stärke und
Der Fruktangehalt im Gras unterliegt großen Schwankungen und hängt von den Grassorten, dem Boden, dem Klima, der Jahreszeit und der Tageszeit ab (Dahlhoff 2003). Die Fruktane werden als Produkte der Photosynthese aus Saccharose gebildet und als Energiereserven für Wachstum und Stoffwechsel der Pflanzen gespeichert. Der Fruktan-Gehalt ist dann besonders hoch ist, wenn die Photosyntheserate hoch ist und das Pflanzenwachstum gering ist.
| Weidegang | Günstig (Fruktangehalt niedrig) | Ungünstig (Fruktangehalt hoch) |
|---|---|---|
| morgens | Nächtliches Wachstum hat Fruktane verbraucht, Photosyntheserate noch gering | |
| schattige Weide | Photosyntheserate geringer als in der Sonne | |
| sommerliche Wärme mit Bewölkung | Wachstum verbraucht Fruktane während Photosyntheserate durch Wolken reduziert ist | |
| Nachmittag und früher Abend | hohe Photosyntheserate sorgt für besonders hohen Fruktangehalt | |
| Sonnenschein bei niedrigen Temperaturen besonders im Frühjahr und Herbst | Photosynthese findet statt und Wachstum ist wegen der Kälte auf dem Nullpunkt. |
|
Auch im Heu schwankt der Fruktananteil erheblich. Heu mit geringen Fruktananteilen von unter 12 % eignet sich besonders für die Pferde mit einer Hufrehe und/oder EMS (Frank 2006). Entscheidend ist immer die Gesamtmenge an Fruktanen, die ein Pferd oder Pony aufnimmt (Eustace 2007).
Rush (2006) empfiehlt das Auswaschen von Fruktanen aus Heu mit hohem Fruktangehalt. Dazu wird das Heu 30 bis 60 Minuten in kaltes Wasser getaucht. Werden Pferde mit gewaschenem Heu gefüttert, ist ein Supplementfutter mit Vitaminen und Spurenelementen besonders wichtig.
Dahlhoff (2003) fand auf Pferdeweiden im Münsterland keine besorgniserregende Fruktangehalte, der höchste Wert betrug 8,2 %. Vergleichsberechnungen zu den Fruktanmengen, mit denen einige Autoren experimentell Hufrehe auslösen, ergaben, dass die im Münsterland festgestellten Fruktangehalte nicht besorgniserregend sind. Das münsterländische Gras mit dem höchsten Fruktangehalt von 8,2 % empfehlen mehrere Autoren sogar für die Fütterung an EMS-Patienten.
Deutsches Weidelgras und einige andere Weidelgräser gehören zu den fruktanreicheren Gräsern während Wiesenlieschgras, Wiesenfuchsschwanz, Knaulgras und Rotschwingel fruktanarm sind und bei der Ansaat einer Pferdeweide vorzuziehen sind (Dahlhoff 2003). Höhere Fruktangehalte im Gras bzw. Heu in den angelsächsischen Ländern könnten ihre Ursache in fruktanreicheren Grassorten auf dortigen Weiden haben.
Das Institut für Tierernährung der Tierärztlichen Hochschule Hannover untersucht Heuproben auf deren Fruktangehalt. Dazu wird eine halbe Einkaufstüte voll Heu benötigt. Die Untersuchung dauert etwa 14 Tage und kostet ca. 70,- € .
Die optimale Fütterung der Pferde mit Stoffwechselerkrankungen stellt die Pferdehalter vor eine große Herausforderung; die richtigen Informationen über unsere Futtermittel zu erhalten, ist schwierig. Das soll an der Frage verdeutlicht werden, ob es sinnvoll ist, seinem Pferd mit einer Insulinresistenz Möhren zu füttern:
Fütterung von Hafer mit einem glykämischen Index von 100 soll vermieden werden, ist es sinnvoll, diesen Patienten Möhren zu füttern? Angaben zum GI von Möhren finden sich bisher nur in der Humanmedizin. Dort wird Weißbrot oder Glukose statt Hafer als Referenznahrungsmittel herangezogen, der GI von Möhren wird mit 71 erstaunlich hoch angegeben. In der Humanmedizin werden die Mengen verschiedener Nahrungsmittel miteinander verglichen, die dieselbe Menge an Kohlehydraten enthalten, deshalb wird eine etwa 7 Mal größere Möhrenmenge mit dem Weißbrot verglichen.
Im Internet finden sich folgende Kalorienangaben (http://kalorientabelle.tv/kalorientabelle.html):
| Hafer | 100 g | 353 kcal |
| Möhren | 100 g | 26 kcal |
| Äpfel | 100 g | 52 kcal |
Daraus folgt, dass Rodiek und Stull (2007) den GI von Möhren ermittelt hätten, in dem sie die Menge leicht verdaulicher Kohlenhydrate in 13,5 kg Möhren bzw. 6,8 kg Äpfel mit deren Menge in 1 kg Hafer verglichen hätten. Angenommen, deren GI-Bestimmung hätte für Möhren einen GI von 71 bzw. für Äpfel von 50 ergeben (etwa diese Werte werden in der Humanmedzin angegeben, allerdings weicht dort die Berechnungsmethode ab), dann hieße das Folgendes:
13,5 kg Möhren enthalten 71 % so viel leicht verdauliche Kohlenhydrate wie 1 kg Hafer.
19 kg Möhren enthalten so viel leicht verdauliche Kohlenhydrate wie 1 kg Hafer.
6,8 kg Äpfel enthalten 50 % so viel leicht verdauliche Kohlenhydrate wie 1 kg Hafer.
13,6 kg Äpfel enthalten so viel leicht verdauliche Kohlenhydrate wie 1 kg Hafer.
Auch in der Humanmedizin wird oft vor Nahrungsmitteln bezüglich ihrer Auswirkungen auf Übergewicht, Herz-Kreislauferkrankungen, Diabetes mellitus Typ II und Schlaganfall gewarnt, die einen hohen GI haben. Allerdings erkennt man hier neuerdings, dass es nicht allein auf den GI ankommt. Der Begriff der glykämischen Last wurde deshalb eingeführt. Dazu wird der GI eines Nahrungsmittels durch 100 geteilt und mit der Menge verzehrter Kohlenhydrate multipliziert. Hierzu ein Beispiel:
Für Möhren wird in der Regel ein GI von 71 angegeben, 100 g Möhren enthalten ca. 7,5 g Kohlenhydrate:
(71 : 100) * 7,5 = 5,3
Weißbrot hat einen GI von 73 und 100 g Weißbrot enthalten 47 g Kohlenhydrate, daraus folgt:
(73 : 100) * 47 = 34
Beim Menschen gilt:
>bis 10 = niedrige glykämische Last
>11 -19 = mittlere glykämische Last
>ab 20 = hohe glykämische Last
Rodiek und Stull (2007) haben in der bisher wertvollsten Untersuchung den GI von 10 in den USA üblichen Futtermitteln ermittelt (siehe gelbe Tabelle oben), es fehlt die Ermittlung der Glykämische Last von bei uns üblichen Pferdefuttermitteln, die Untersuchung von folgenden Futterrationen erscheint mir sinnvoll:
1 kg Hafer als Referenzwert
1 kg Gerste
1 kg Müsli ohne Hafer
1 kg Spezialfutter (für Pferde mit Insulinresistenz)
1 kg Möhren
1 kg Äpfel
4 kg Heu
Meines Erachtens wäre es dem Pferdehalter mit dem Wissen über die Glykämischen Last der Pferdefuttermittel wesentlich eher möglich, ein Pferd mit Insulinresistenz optimal zu füttern.
Brunken G (1985): Die prognostische Bedeutung der röntgenologischen Untersuchung bei der chronischen Hufrehe des Pferdes. TiHo Hannover, Diss.
Budras K-D, Buda S, Hirschberg R, Mülling C, Nöller C, König HE, Schnitger P und Frohnes A-K (2005): Hufrehe – ein aktueller Überblick. pferde spiegel, 3: 126-132
Dahlhoff S (2003): Fruktangehalt im Gras von Pferdeweiden während der Weidesaison 2002. TiHo Hannover, Diss.
Davis E G (2005): Equine metabolic syndrome. In: Proc North Am Vet Conference 2005: 140-143
Eustace RA (2007): Dietary factors involved in the induction of equine laminitis. In: 10th Geneva Congress of Equine Medicine and Surgery 2007: 165-166
Frank N (2006): Insulin resistance in horses. In: Proc Annual Convention of the AAEP, San Antonio, Tx, 2006: 51-54
Hoffmann RM (2003): Carbohydrate metabolism in horses. In: Recent advances in equine nutrition, S.L. Ralston and H.F. Hintz (Eds.)
Klein H-J, Schulze E, Deegen E und Giese W (1988): Metabolism of naturally occuring [13C]glucose given orally to horses. Am J Vet Res 49: 1259-1262
Menzies-Gow N (2008): The pathogenesis of equine pasture-associated laminitis. In: Abstracts European Veterinary Conference Voorjaarsdagen, 2008: 274-275
Pollitt CC (2008 a): Scientific Update on the pathophysiology of laminitis In: 14th ESVOT Congress, Munich, 2008: 263-267
Pollitt CC (2008 b): Scientific advances in prevention and treatment of laminitis. In: 14th ESVOT Congress, Munich, 2008: 268-272
Reichelt U, Hamann J und Grabner A (2009): Das Equine Metabolische Syndrom: Diagnostik und Fallbeispiele. Prakt Tierarzt 90: 548-554
Rodiek AV. und Stull CL (2007): Glycemic index of ten common horse feeds. J Equine Vet Sci 27: 205-211
Rush BR (2006): Obesity and Laminitis. In: The North American Veterinary Conference -2006: 214
Schott HC, Coursen CL, Eberhart SW, Nachreiner RJ, Refsal KR, Ewart SL und Merteniuk JV (2001): The Michigan Cushing’s Project. In: Proc Ann Conv AAEP 47: 22-24
Stull CL (2008): The Skinny on Carbohydrates and body size of horses. In: Proc 27th Ann Horse Breeders and Owners Conf, Alberta, Canada, Jan 9-11, 2008